宇宙生活での健康リスク低減を目指した運動による生体恒常性の頑健性獲得機構の解明 - 公募研究 2016-2017
| 研究課題名 | 宇宙生活での健康リスク低減を目指した運動による生体恒常性の頑健性獲得機構の解明 |
|---|---|
| 研究代表者 |

|
目的
適度な運動が健康寿命を延ばすことが科学的に実証され、その医療応用が近年注目されている。しかし、多くの患者は症状の重篤さや加齢により、通常歩行すら厳しいのが現実である。これは、宇宙空間での生活が抱える慢性的な運動不足と同一の問題である。申請者は最近、末梢循環障害や慢性心不全の誘導分子としてこれまで見出してきた創薬標的分子(TRPC3/6チャネルとプリン作動性P2Y6受容体(P2Y6R))が、力学的負荷により(リガンド非依存的に)直接活性化されることを明らかにした。本研究では、運動負荷の受容・応答と上記メカノ作動性分子との関係を個体レベルで明らかにし、そのシグナル制御機構を基に、上記メカノ作動性分子を化学的に操縦する方法を構築することで、運動を模倣する創薬(全身筋組織の恒常性維持力を高める創薬)の可能性を動物レベルで実証することを目的とする。
これまでの研究概要
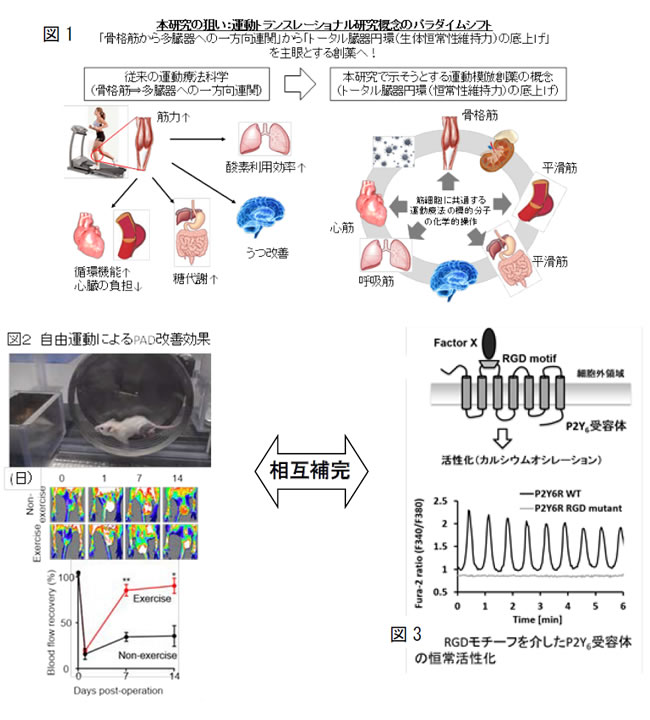
適度な運動が心不全や鬱病をはじめとする様々な病態に対して有効であることがヒトで報告され、そのメカニズム研究が近年注目されている。しかし、その多くは運動負荷の感知・応答組織である足の骨格筋に限局した研究であり、創薬への応用を意識した筋細胞組織に共通するメカニズムの解明を目的とした研究は全くなされていない(図1)。
血液循環を支える筋細胞(心臓(心筋)や血管(平滑筋))は、血行力学的な負荷に常に曝されながらも上手に適応し、血液循環の恒常性維持に貢献している。申請者はこれまで心臓が圧負荷に対して適応から不適応へとシグナル変換する(つまり心不全を形成する)メカニズムを研究し、その仲介分子として、カチオンチャネル(TRPC3とTRPC6; TRPC3/6)とP2Y6Rを見出してきた。その機序として、TRPC3/6とP2Y6Rがそれぞれ特定の膜タンパク質と複合体を形成することで、心血管リモデリング形成に寄与することを明らかにした。さらに、これらが機械的伸展刺激や周囲の硬さを感知して直接活性化される力学刺激受容分子として働くことも上記研究の中で見出している(図1)。こうした知見を基に、それぞれの遺伝子欠損マウスを用いて心不全や高血圧、末梢循環障害における役割を調べたところ、以下の3つを新たに見出した。
A. エクササイズ(自由運動)はTRPC6をリン酸化依存的に抑制することで末梢循環障害を改善する。TRPC6阻害は自由運動させたマウスと同程度の末梢循環障害改善効果を示す(図2)。
B. 筋不全時の赤筋(心筋および骨格筋)ミオグロビン発現低下はTRPC3/6阻害により抑制される。TRPC6阻害は平滑筋細胞の虚血後の分化・脱分化サイクルを促進させる。
C. P2Y6Rはアンジオテンシン受容体とヘテロ2量体を形成し、高血圧リスクを増加する。これらの知見は、TRPC3/6やP2Y6Rが心筋だけでなく、骨格筋や血管平滑筋細胞の恒常性維持においても重要なメカノ作動性分子となることを強く示唆している。
本年度の研究計画
横紋筋・平滑筋細胞の筋分化におけるメカノ作動性分子の役割解析
血管平滑筋細胞(VSMCs)は増殖型~収縮型への表現型をフレキシブルに変化させることで血管恒常性を維持している。VSMCsへの15-20%の周期的な伸展刺激が増殖シグナルとなる一方で、周囲環境の硬化が筋分化を促進・固定することが知られている。当分野は硬さを変えたシリコンチャンバーと伸展刺激装置(Menicon life science)を設置しており、マウスVSMCsの単離・初代培養技術も既に確立している。そこで、シリコンチャンバー上に野生型(WT)あるいは遺伝子欠損(TRPC-KO, P2Y6R-KO)マウスから単離した下行大動脈由来のVSMCsを播種し、10~20%の伸展刺激を与え、VSMCsの増殖・分化にメカノ作動性分子が与える影響を解析する。マウス骨格筋の筋芽細胞は酵素的に単離し、FACSで分離・培養する方法も確立している。予試験ではTRPCチャネルの阻害が筋芽細胞の過分極を誘発することで容量性のCa2+流入を増加し、結果的に骨格筋細胞への文化を促進する可能性を見出している。TRPC3/6だけでなくP2Y6RもCa2+動員型受容体であることから、WTと各KOマウスの筋芽細胞を用いてVSMCsと同様の検討を行い、骨格筋細胞への分化に対する上記メカノ作動性分子の役割を明らかにする。
メカノ作動性分子の力学負荷の受容・応答特性解析
P2Y6Rを発現させたHeLa細胞をある硬度のシリコンチャンバー上に播種すると、それだけで自発活性(Ca2+オシレーション)が観察できる(図3)。この応答はP2Y6R特有の細胞外インテグリン結合(RGD)モチーフ依存的であり、TRPC3, TRPC6チャネル過剰発現では再現できない。そこで、P2Y6R自発活性に必要な細胞外基質(Factor X)を特定し、細胞外環境がP2Y6R依存的な力学受容・応答に与える影響を解明する。
一方、P2Y6Rを過剰発現させたラット心筋由来の筋芽細胞株H9C2に20%の機械的伸展刺激を行うと、P2Y6Rはリガンド非依存的に活性化する。この応答はTRPC3, TRPC6過剰発現でも再現できる。そこで、細胞周囲環境(ディッシュの硬さや細胞外基質タンパク質(コラーゲンやラミニンなど)のコーティング条件)を変えた際に機械的伸展刺激に対する各メカノ作動性分子の応答がどう変化するか網羅的に解析する。